Test en linea link para hacerlo:
https://es.educaplay.com/es/recursoseducativos/925086/html5/test_de_enlaces_quimicos.htm
jueves, 27 de julio de 2017
TEST EN LINEA
martes, 25 de julio de 2017
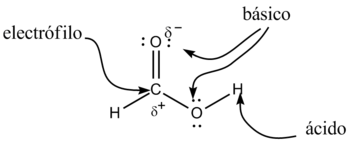
ÁCIDO CARBOXÍLICO
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH ó -CO2H.
Características y propiedades
Los ácidos carboxílicos tienen como fórmula general R-COOH. Tienen propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones una ruptura heterolítica, cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.

REACCIÓN QUÍMICA
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias, llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total
ENLACE QUÍMICO
Enlace químico
Un enlace químico es la interacción física responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos.
Las moléculas, cristales, y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) está unido por enlaces químicos, que determinan las propiedades físicas y químicasde la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
¿CÓMO SE UNEN LOS ÁTOMOS PARA FORMAR MOLÉCULAS?
Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la electrodinámica cuántica.[1] Sin embargo, en la práctica los químicos suelen apoyarse en la mecánica cuántica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su descripción del enlace químico. En general, el enlace químico fuerte está asociado con la compartición o transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos -o sea la mayor parte del ambiente físico que nos rodea- está unido por enlaces químicos, que determinan la estructura de la materia.
COMPUESTOS QUIMICOS
Como se Forman Los Compuestos Quimicos
Los compuestos químicos están formados por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos (reacción química, que se puede conseguir con un reactor químico).
OJO puede darse el caso que los dos elementos no reaccionen, en este caso, si no hubieran reaccionado formarían una mezcla (homogénea o heterogénea) y NO un compuesto químico.
Los compuestos químicos tienen una proporción fija, ya que si los elementos iniciales fueran los mismos, pero cambiáramos la proporción (cantidad) de cada uno de ellos, el compuesto ya no sería el mismo porque tendría propiedades diferentes.
Según lo dicho, los compuestos químicos tienen átomos agrupados de los elementos inicialeso lo que se llaman moléculas.
Por ejemplo si hacemos que reaccionen 2 átomos de hidrógeno con 1 de oxigeno, obtendríamos uncompuesto químico llamado agua = H2O.
Compuestos Iónicos, Covalentes y metálicos. Pero hay otras formas de clasificarlos. Veamos las más importantes.
En función de Orgánico o Inorgánico:
- Compuestos Químicos Orgánicos: Contienen como mínimo un átomo de carbono y a menudo un átomo de hidrógeno, para formar hidrocarburos.
- Compuestos Químicos Inorgánicos: No contienen átomos de Carbono.
Otra clasificación más concreta sería en función de sus componentes:
- Óxidos básicos: están formados por un metal y oxígeno. Por ejemplo, el óxido plúmbico y el óxido de litio.
- Óxidos ácidos: formados por un no metal y oxígeno. Por ejemplo, óxido hipocloroso y el óxido selenioso.
- Hidruros: pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento cualquiera e hidrógeno. Por ejemplo, hidruro de aluminio y el hidruro de sodio.
- Hidrácidos: son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico.
- Hidróxidos: compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio o la sosa cáustica.
- Oxoácidos: compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo el ácido clórico.
- Sales binarias: compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio.
- Oxisales: formadas por la reacción de un oxoácido y un hidróxido, como por ejemplo el hipoclorito de sodio.
OJO puede darse el caso que los dos elementos no reaccionen, en este caso, si no hubieran reaccionado formarían una mezcla (homogénea o heterogénea) y NO un compuesto químico.
Los compuestos químicos tienen una proporción fija, ya que si los elementos iniciales fueran los mismos, pero cambiáramos la proporción (cantidad) de cada uno de ellos, el compuesto ya no sería el mismo porque tendría propiedades diferentes.
Según lo dicho, los compuestos químicos tienen átomos agrupados de los elementos inicialeso lo que se llaman moléculas.
Por ejemplo si hacemos que reaccionen 2 átomos de hidrógeno con 1 de oxigeno, obtendríamos uncompuesto químico llamado agua = H2O.
Tipos de Compuestos Quimicos
Según lo que dijimos anteriormente podríamos clasificar los compuestos químicos en función de sus enlace:Compuestos Iónicos, Covalentes y metálicos. Pero hay otras formas de clasificarlos. Veamos las más importantes.
En función de Orgánico o Inorgánico:
- Compuestos Químicos Orgánicos: Contienen como mínimo un átomo de carbono y a menudo un átomo de hidrógeno, para formar hidrocarburos.
- Compuestos Químicos Inorgánicos: No contienen átomos de Carbono.
Otra clasificación más concreta sería en función de sus componentes:
- Óxidos básicos: están formados por un metal y oxígeno. Por ejemplo, el óxido plúmbico y el óxido de litio.
- Óxidos ácidos: formados por un no metal y oxígeno. Por ejemplo, óxido hipocloroso y el óxido selenioso.
- Hidruros: pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento cualquiera e hidrógeno. Por ejemplo, hidruro de aluminio y el hidruro de sodio.
- Hidrácidos: son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico.
- Hidróxidos: compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio o la sosa cáustica.
- Oxoácidos: compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo el ácido clórico.
- Sales binarias: compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio.
- Oxisales: formadas por la reacción de un oxoácido y un hidróxido, como por ejemplo el hipoclorito de sodio.
SUSTANCIAS QUIMICAS DE USO COTIDIANO
La contaminación química es uno de los problemas ambientales más actuales en el mundo. La contaminación química constituye una alteración de nuestro entorno.
Los expertos consideran que las sustancias químicas presentes en todo tipo de productos de consumo cotidiano constituyen la principal fuente de contaminación. Todos los hogares deben desarrollar una cultura de seguridad química, a fin de prevenir riesgos a la salud y al ambiente haciendo un consumo responsable, particularmente de los productos que contienen sustancias corrosivas, tóxicas o inflamables las cuales se convierten en residuos peligrosos.
Introducción
Las sustancias químicas se han convertido en componentes esenciales de la sociedad, debido a que contribuyen de diversas maneras a establecer y/o preservar un nivel de vida alto en países de todos los grados de desarrollo. En los últimos años, se ha ampliado la gama de productos químicos contribuyendo a aumentar la expectativa de vida y a mejorar las condiciones del entorno. Muchas de las sustancias químicas que se utilizan para mejorar nuestra calidad de vida no son perjudiciales ni para el medio ambiente ni para la salud humana. Sin embargo, hay sustancias químicas que, en determinadas cantidades, pueden ser nocivas y sólo deben utilizarse cuando sus riesgos puedan controlarse adecuadamente. Gran cantidad de sustancias químicas utilizadas en la vida diaria están sujetas a una serie de procesos naturales los cuales están determinados por sus propiedades físicas y químicas, las condiciones de su liberación al medio ambiente, por ejemplo emisiones al aire o al agua y condiciones del medio ambiente como la temperatura del medio receptor y la cantidad de radiación solar. Debido a estos factores, una sustancia química se transportará a distancias cortas o largas debido a procesos naturales del medio ambiente (aire y/o agua) la cual se transformará y degradará en otras sustancias químicas.
A pesar de que gran cantidad de sustancias químicas se degradan rápidamente en el medio ambiente, algunas se liberan en altas concentraciones. Otras sustancias químicas tienen ciertas propiedades físicas y químicas que una vez liberadas en el medio ambiente se degradan lentamente y permanecen en el medio ambiente por años o inclusive décadas aun cuando sean liberadas en cantidades relativamente pequeñas; a estas se les llaman persistentes.
Los beneficios de las sustancias químicas son como por ejemplo el uso de medicamentos para controlar enfermedades, en la agricultura para incrementar la producción de alimentos, el desarrollo de mejores combustibles, asi como nuevos materiales para su uso en el transporte, ropa y equipo electrónico.
Suscribirse a:
Comentarios (Atom)

